Hvad er Scenesse - afamelanotid og hvad bruges det til?
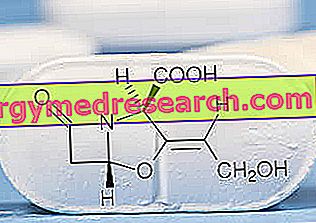
Scenesse er en plante, der anvendes til behandling af patienter med erytropoietisk protoporphyria (EPP), en sjælden sygdom, der forårsager lysintolerans. Hos patienter med EPP kan udsættelse for lys forårsage symptomer såsom smerte og hævelse i huden, som forhindrer dem i at være udendørs eller steder med intens lys. Scenesse er indiceret til forebyggelse eller reduktion af disse symptomer, så patienterne kan leve et mere normalt liv. Fordi antallet af patienter med EPP er lavt, betragtes sygdommen som "sjælden" og Scenesse blev kvalificeret som "lægemiddel til sjældne sygdomme" (et lægemiddel, der anvendes i sjældne sygdomme) den 8. maj 2008. Scenesse indeholder det aktive stof afamelanotid .
Hvordan anvendes Scenesse - afamelanotid?
Scenesse bør kun ordineres af specialiserede læger, i centre, der er godkendt til behandling af EPP, og bør kun anvendes af behørigt uddannede medicinske eksperter. Et Scenesse implantat indsættes i patientens subkutane væv hver anden måned før og i perioder med øget udsættelse for sollys, fx fra forår til efterår. Antallet af implantater indsat hvert år afhænger af, hvor meget beskyttelse der kræves fra sollys. det
Hvordan virker Scenesse - afamelanotid?
Den aktive ingrediens i Scenesse, afamelanotid, ligner et hormon i kroppen kaldet alfa-melanocytstimulerende hormon, som stimulerer produktionen af et brun-sort pigment i huden. Dette pigment, kendt som eumelanin, fremstilles under udsættelse for sollys for at blokere lysets indtrængning i celler. Høje niveauer af et stof kaldet protoporphyrin IX findes i kroppen af EPP patienter. Protoporphyrin IX er fototoksisk og forårsager, hvis de udsættes for lys, de smertereaktioner, der observeres hos patienter, der lider af denne tilstand. Ved at stimulere produktionen af eumelanin i huden reducerer Scenesse indtrængningen af lys gennem huden og hjælper med til at forhindre smertefulde reaktioner.
Hvilken fordel har Scenesse - afamelanotid vist under undersøgelserne?
Under en undersøgelse har Scenesse vist sig at fremkalde en stigning i tiden, som patienterne kan bruge på steder, der udsættes for sollys. I undersøgelsen, hvor 93 patienter med EPP deltog, blev patienter behandlet med Scenesse eller placebo (en dummybehandling) i mere end seks måneder. Fra de daglige optegnelser for udsættelse for sollys mellem kl. 10.00 og 18.00 blev det konstateret, at patienter behandlet med Scenesse brugte i gennemsnit 116 timer under direkte sollys uden at have haft smerter i undersøgelsens seks måneder sammenlignet med 61 timers patienter behandlet med placebo.
Hvad er risikoen forbundet med Scenesse - afamelanotid?
De mest almindelige bivirkninger, der blev observeret i studierne med Scenesse, var kvalme, hovedpine og reaktioner på implantatstedet (herunder ændring af hudfarve, smerte og rødme). Disse reaktioner involverede ca. 1 ud af 5 patienter og viste generelt en mild grad af sværhedsgrad. Scenesse bør ikke gives til patienter med nedsat lever- eller nyrefunktion. Den fuldstændige liste over alle bivirkninger og restriktioner med Scenesse findes i indlægssedlen.
Hvorfor er Scenesse - afamelanotid blevet godkendt?
Agenturets Udvalg for Humanmedicinske Lægemidler (CHMP) besluttede, at Scenesse's fordele er større end risiciene og anbefalede, at det godkendes til brug i EU. CHMP bemærkede, at Scenesse førte til en stigning i varigheden af patienternes eksponering for direkte sollys uden smerter. Selv om denne stigning i varigheden af udsættelse for sollys er beskeden, har udvalget taget hensyn til potentielle forbedringer i livskvaliteten, unmet medicinsk efterspørgsel hos patienter med EPP og ved at beslutte at anbefale tilladelse til Scenesse i EU. milde bivirkninger observeret under kort behandling med medicinen. Udvalget har også individuelt konsulteret patienter og eksperter om deres erfaring med Scenesse. Scenesse blev godkendt under "usædvanlige omstændigheder", fordi det ikke var muligt at få fuldstændige oplysninger om Scenesse på grund af sygdommens sjældenhed. Hvert år gennemgår Det Europæiske Lægemiddelagentur de nye oplysninger, der er til rådighed, og dette resumé opdateres i overensstemmelse hermed. Hvilke foranstaltninger træffes der for at sikre en sikker og effektiv anvendelse af Scenesse - afamelanotid?
Hvilke oplysninger ventes stadig på Scenesse - afamelanotid?
Som Scenesse har fået tilladelse i ekstraordinære tilfælde, vil det selskab, der markedsfører Scenesse, give langsigtede data om medicinens fordele og sikkerhed, der hidrører fra et EU-register over patienter, der tager medicinen.
Hvilke foranstaltninger træffes for at sikre sikker og effektiv brug af Scenesse - afamelanotid?
En risikostyringsplan er udviklet for at sikre, at Scenesse bruges så sikkert som muligt. På baggrund af denne plan er sikkerhedsinformation inkluderet i resuméet af produktegenskaber og indlægssedlen til Scenesse, herunder de passende forholdsregler, der skal følges af sundhedsvæsenets fagfolk og patienter. Desuden vil firmaet, der markedsfører Scenesse, distribuere informationsmateriale til læger og instruere dem i brugen af medicinen. Derudover vil læger få oplysninger om EU-registret. Yderligere information findes i resuméet af risikostyringsplanen.
Flere oplysninger om Scenesse - afamelanotid
Den 22. december 2014 udstedte Europa-Kommissionen en markedsføringstilladelse til Scenesse, der var gyldig i hele EU. For yderligere oplysninger om Scenesse terapi, læs indlægssedlen (også en del af EPAR) eller kontakt din læge eller apotek. Resuméet af udtalelsen fra Udvalget for Lægemidler til Sjældne Sygdomme, der er relateret til Scenesse, findes på agenturets hjemmeside: ema.Europa.eu/Find medicin / Human medicine / Sjældne sygdomsbetegnelser. Sidste opdatering af dette resumé: 12-2014.