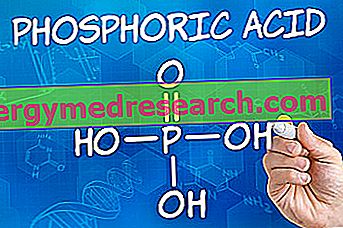
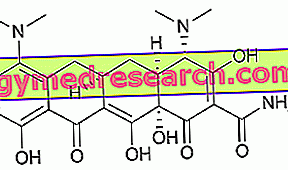
Hvad anvendes Lynparza - olaparib til?
Lynparza er et kræftmedicin, der er indiceret til behandling af "vedligeholdelse" af voksne patienter med høj grad af serøs epithelial ovariecancer (en type avanceret ovariecarcinom), herunder æggeleders carcinom (en del af reproduktionssystemet kvindelig forbinder æggestokkene til livmoderen) og karsinom i peritoneum (underlivet i underlivet). Lynparza anvendes til patienter med mutationer (defekter) i et af de to gener, der er kendt som BRCA1 og BRCA2, og som viser tilbagevendende tilbagefald (dvs. tilbagefald af karcinom efter behandling). Lynparza administreres efter terapi med platinbaserede lægemidler, når karcinomets størrelse er faldet, eller tumormassen er helt forsvundet. Det gives til patienter, hvor tidligere behandling med platinbaserede lægemidler har givet et varigt svar (varer mindst 6 måneder). Lynparza indeholder det aktive stof olaparib . Da antallet af patienter med ovariecancer er lav, betragtes sygdommen som sjælden, og Lynparza blev udpeget som "lægemiddel til sjældne sygdomme" (et lægemiddel, der anvendes i sjældne sygdomme) den 6. december 2007.
Hvordan anvendes Lynparza - olaparib?
Lynparza fås som kapsler (50 mg), der skal tages i munden. Lægemidlet kan kun fås på recept, og behandlingen skal startes og overvåges af en læge, der har specialiseret sig i behandling af kræft. Inden behandlingen påbegyndes, bør patienter sørge for, at de har en BRCA-genmutation. Evaluering af mutationsstatus skal udføres i et passende laboratorium ved hjælp af genetisk testning. Behandling med Lynparza bør startes inden for 8 uger efter at have taget den sidste dosis platinbaseret kemoterapi. Den anbefalede dosis Lynparza er 400 mg (otte kapsler), der skal tages to gange om dagen. Behandlingen kan stoppes, og doser kan reduceres ved bivirkninger. Lynparza bør tages mindst en time efter fødeindtagelse, og patienter bør afstå fra at spise helst op til to timer senere. For yderligere information, se indlægssedlen.
Hvordan virker Lynparza - olaparib?
Den aktive ingrediens i Lynparza, olaparib, blokerer virkningen af humane enzymer kaldet poly (ADP-ribose) polymerase (PARP), som bidrager til reparation af beskadiget DNA i celler (både sunde og cancerøse) under celledeling. I sunde celler findes der en alternativ mekanisme til reparation af DNA, der kræver BRCA1- og BRCA2-proteinerne. Denne alternative mekanisme virker ikke korrekt i tumorceller, som udviser mutationer i BRCA1- eller BRCA2-genet. Derfor, når PARP-proteiner er blokeret, kan det beskadigede DNA i cancerceller ikke repareres, og som følge heraf dør kræftceller.
Hvilken fordel har Lynparza - olaparib vist under undersøgelserne?
Lynparza har vist sig at forøge tidsperioden, hvor patienterne ikke udviser en forværring af sygdommen i et hovedstudie, der involverer 265 patienter med højtstående serøse ovariecarcinomer, herunder æggeledercarcinom eller peritoneal carcinom. Patienterne havde gennemgået to eller flere kurser af platinbaseret kemoterapi og havde et varigt svar (tumoren var ikke udviklet i mindst 6 måneder) før den sidste terapeutiske cyklus. Dette svar på platinbaserede lægemidler begrundede brugen af den sidste platinbaserede behandling. Lynparza blev indgivet inden for 8 uger efter det sidste kursus af platinbaseret kemoterapi, da tumormassen var i recession eller helt forsvundet. Omkring halvdelen af patienterne, der deltog i undersøgelsen, havde BRCA mutationer. I de fleste tilfælde var disse arvede mutationer. Patienter med en BRCA-mutation behandlet med Lynparza overlevede i gennemsnit længere uden tegn på sygdomsfremgang sammenlignet med patienter med en BRCA-mutation, der blev behandlet med placebo (en dummybehandling) eller 11, 2 måneder sammenlignet med 4, 3 måneder .
Hvad er risikoen forbundet med Lynparza - olaparib?
De mest almindelige bivirkninger af Lynparza (som kan påvirke mere end 1 ud af 10 personer) er træthed, kvalme, opkastning, diarré, dyspepsi (halsbrand), hovedpine, dysgeusi (smagsforstyrrelse), nedsat appetit, svimmelhed, anæmi (fald i antallet af røde blodlegemer i blodet), lymfopeni og neutropeni (fald i antallet af bestemte typer af hvide blodlegemer), stigning i det gennemsnitlige corpuskulære volumen (stigning i den gennemsnitlige størrelse af røde blodlegemer) og forøgelse af kreatinin (tilstedeværelsen af høje niveauer af kreatinin i blodet indikerer problemer med nyrefunktionen). Den fuldstændige liste over alle indberettede bivirkninger ved Lynparza findes i indlægssedlen. Amning er kontraindiceret under behandling med Lynparza og mindst en måned efter den sidste dosis. Den fuldstændige liste over begrænsninger findes i indlægssedlen.
Hvorfor er Lynparza - olaparib blevet godkendt?
Agenturets Udvalg for Humanmedicinske Lægemidler (CHMP) besluttede, at fordelene ved Lynparza er større end risiciene og anbefalede, at det godkendes til brug i EU. CHMP er af den opfattelse, at fordelene ved Lynparza til forlængelse af kræftpatienternes overlevelse med en BRCA-mutation inden sygdomsprogression er klinisk relevant. Hos disse patienter, som normalt har en dårlig diagnose, var der en samlet forsinkelse på 6, 9 måneder i sygdommens fremgang, hvilket kunne tillade den efterfølgende platinbaserede kemoterapibehandling at blive forsinket. Med hensyn til sikkerhed var bivirkningerne for det meste milde eller moderate og viste sig generelt at være håndterbare. CHMP bemærkede også, at yderligere undersøgelser er nødvendige for yderligere at bekræfte fordelene ved Lynparza, dets virkninger på overlevelse og dets langsigtede sikkerhed.
Hvilke foranstaltninger er der truffet for at sikre en sikker og effektiv anvendelse af Lynparza - olaparib?
Der er udviklet en risikostyringsplan for at sikre, at Lynparza anvendes så sikkert som muligt. På baggrund af denne plan er sikkerhedsoplysning inkluderet i resuméet af produktegenskaber og indlægssedlen til Lynparza, herunder de relevante forholdsregler, der skal følges af sundhedsvæsenets fagfolk og patienter. Derudover vil selskabet, der markedsfører Lynparza, udføre undersøgelser for yderligere at bekræfte fordelene ved medicinen, herunder den langsigtede fordel hos patienter med ovariecancer.
Flere oplysninger om Lynparza - olaparib
Den 16. december 2014 udstedte Europa-Kommissionen en markedsføringstilladelse til Lynparza, der var gyldig i hele EU. For yderligere oplysninger om behandling med Lynparza, læs indlægssedlen (også en del af EPAR) eller kontakt din læge eller apotek. Resuméet af udtalelsen fra udvalget for lægemidler til sjældne sygdomme relateret til Lynparza findes på agenturets hjemmeside: ema.Europa.eu/Find medicin / Human Medicine / Udpegning af sjældne sygdomme. Sidste opdatering af dette resumé: 12-2014.