Hvad er Temodal?
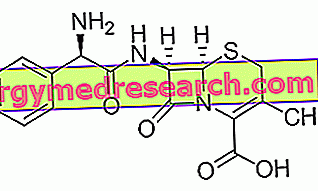
Temodal er et lægemiddel, der indeholder det aktive stof temozolomid. Den er tilgængelig i kapsler (hvid og grøn: 5 mg, hvid og gul: 20 mg, hvid og lyserød: 100 mg, hvid og blå: 140 mg, hvid og orange : 180 mg, hvid: 250 mg) og pulveriseret til fremstilling af en opløsning til infusion (dryp i en vene).
Hvad anvendes Temodal til?
Temodal er en anticancer medicin, der anvendes til behandling af maligne gliomer (hjernetumorer) i følgende patientgrupper:
- voksne med nyligt diagnosticeret glioblastom multiforme (en særlig aggressiv type hjernetumor). Temodal anvendes først i forbindelse med strålebehandling og senere som et enkelt middel (alene);
- voksne og børn fra tre år med maligne gliomer, såsom glioblastom multiforme eller anaplastisk astrocytom, når tumoren vender tilbage eller udvikler sig efter standardterapi. Temodal anvendes alene i disse patienter.
Lægemidlet kan kun fås på recept.
Hvordan anvendes Temodal?
Behandling med Temodal bør ordineres af en læge med erfaring i behandling af hjernetumorer.
Temodal dosen afhænger af kroppens overflade (beregnet ud fra patientens højde og vægt) og varierer fra 75 til 200 mg pr. Kvadratmeter, en gang om dagen. Både dosering og antallet af doser afhænger af den type tumor, der skal behandles, hvis patienten tidligere er blevet behandlet, hvis Temodal anvendes alene eller i kombination med andre terapier og ved patientens respons på behandlingen. Temodal kapsler bør tages uden mad. Hvis infusionsopløsningen tages, skal den indgives i løbet af 90 minutter.
Endvidere må patienter muligvis tage medicin, der forhindrer opkastning før administration. Temodal bør anvendes med forsigtighed til patienter med alvorlige leverproblemer eller nyresvigt.
For mere information, se resuméet af produktegenskaber (også inkluderet i EPAR).
Hvordan virker Temodal?
Det aktive stof i Temodal, temozolomid, tilhører en gruppe af kræftmidler, der kaldes alkyleringsmidler. I organismen omdannes temozolomid til en anden forbindelse kaldet MTIC. MTIC binder til celled DNA under reproduktionsfasen og derved blokererer celledeling. Som et resultat kan kræftceller ikke opdele, og tumorvækst er bremset.
Hvordan har Temodal været undersøgt?
Temodal kapsler er blevet undersøgt i fire hovedstudier.
Den første undersøgelse undersøgte effekten af Temodal og strålebehandling med strålebehandling som monoterapi hos 573 patienter med nyligt diagnosticeret glioblastom multiforme.
De øvrige tre hovedundersøgelser involverede patienter med malignt gliom igen eller forværret efter tidligere behandling. To af disse undersøgelser involverede patienter med glioblastom multiforme: man undersøgte virkningerne af Temodal hos 138 patienter, mens den anden sammenlignede Temodal med procarbazin (en anden anticancermedicin) hos 225 patienter. Det tredje studie undersøgte sikkerhed og effekt af Temodal til behandling af 162 patienter med anaplastisk astrocytom ved første tilbagefald.
Det vigtigste mål for effektivitet var patientens overlevelsestid eller tiden der gik, før tumoren begyndte at blive værre.
To andre undersøgelser blev udført på i alt 35 hjernedumorpatienter for at vise, at kapslerne og opløsningen til infusion producerer de samme niveauer af temozolomid i blodet.
Hvilken fordel har Temodal vist under undersøgelserne?
I undersøgelsen af nyligt diagnosticerede patienter med glioblastom multiforme var medianoverlevelsen 14, 6 måneder hos patienter behandlet med Temodal og strålebehandling sammenlignet med 12, 1 måneder hos patienter behandlet alene med strålebehandling.
I den sammenlignende undersøgelse af glioblastom multiforme, der opstod eller forværret efter tidligere behandling, forekom forværringen af tumoren i gennemsnit efter 2, 9 måneder hos patienter, der fik Temodal sammenlignet med 1, 9 måneder hos patienter behandlet med procarbazin. I anaplastisk astrocytom forekom forværringen af tumoren i gennemsnit efter 5, 4 måneder hos patienter behandlet med Temodal.
Hvad er risikoen forbundet med Temodal?
De mest almindelige bivirkninger ved Temodal (set hos mere end 1 ud af 10 patienter) er kvalme, opkastning, forstoppelse, anoreksi (tab af appetit), alopeci (hårtab), hovedpine, træthed, kramper, udslæt, neutropeni eller lymfopeni (lave koncentrationer af hvide blodlegemer) og trombocytopeni (lavt antal blodplader). Patienter, der tager infusionsvæsken, kan også opleve reaktioner på injektionsstedet, såsom smerte, irritation, kløe, varme, hævelse, rødme og blå mærker. Den fuldstændige liste over alle indberettede bivirkninger hos Temodal findes i indlægssedlen.
Temodal bør ikke anvendes til personer, der kan være overfølsomme (allergiske) over for temozolomid, til et hvilket som helst af de andre stoffer eller til dacarbazin (en anden anticancer medicin). Temodal bør ikke gives til patienter med svær myelosuppression (en tilstand, hvor knoglemarven ikke kan producere tilstrækkelige blodlegemer).
Hvorfor er Temodal blevet godkendt?
Udvalget for Humanmedicinske Lægemidler (CHMP) besluttede, at fordelene ved Temodal er større end dets risici ved behandling af patienter med første diagnosticeret glioblastom multiforme samtidig med strålebehandling og senere som monoterapi eller med ondartet gliom, som f.eks. glioblastom multiforme eller anaplastisk astrocytom, som gentager eller progressioner efter standardterapi. Udvalget anbefalede, at Temodal fik markedsføringstilladelse.
Flere oplysninger om Temodal
Den 26. januar 1999 udstedte Europa-Kommissionen en markedsføringstilladelse med gyldighed i hele Den Europæiske Union for Temodal til SP Europe. Markedsføringstilladelsen blev fornyet den 26. januar 2004 og den 26. januar 2009.
Den fulde EPAR for Temodal findes her.
Sidste opdatering af dette resumé: 01-2009