morfologi
På et makroskopisk niveau kan en variabel grad af kortikal atrofi (reduktion af væv eller organmasse) observeres i Alzheimers sygdom, der er kendetegnet ved forstørrelse af parietalfurerne, mere accentueret i de frontale, tidsmæssige og parietale lobes. Denne atrofi kompenseres ved en udvidelse af de ventrikulære hulrum sekundært til tabet af parenchyma (figur 1). Især i sygdommens avancerede stadier har strukturerne i den mediale temporal lob, herunder hippocampus, entorhinal cortex og amygdala, alvorligt atrofi givet deres inddragelse fra begyndelsen af patologien.
Desuden præsenterer Alzheimers sygdom også mikroskopiske ændringer, der er kendt som ekstracellulære senile plaques og intracellulære neurofibrillære klynger, som udgør grundlaget for histologisk diagnose. Med sygdommens fremgang er der et alvorligt neuronalt tab ledsaget af gliose (omskrevet eller diffus proliferation, reaktiv i naturen, af neurogliaceller, det vil sige celler, der udgør den bærende stroma af nervesvæv) i de samme regioner hvor tilstedeværelsen af neurofibrillære plaques og klynger er større.
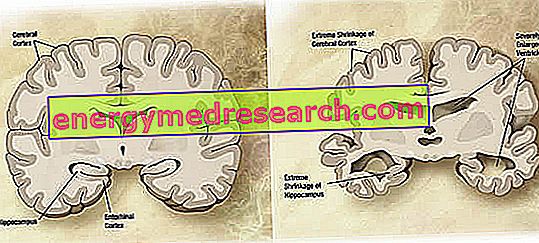
Figur 1. Koronal del af hjerne: Forskelle mellem normal hjerne og hjerne påvirket af AD (wikipedia billedkilde).
patogenese
Alzheimers sygdom er primært præget af to typiske læsioner: Den ekstracellulære akkumulering af senile plaques, der hovedsagelig består af β-amyloidpeptid (Aβ) og intraneuronale neurofibrillære klynger, dannet af hyperphosphoryleret tau-protein.
- Senile plaques kan findes på niveauet af hjerneområder som hippocampus, amygdala og neocortex.
Ap-peptid stammer fra et proteolytisk snit af amyloidproteinprecursoren (APP) ved β-sekretase. Denne snit genererer et terminal carboxy-fragment på 99 rester (CTF eller C99), som efterfølgende skæres af p-sekretasen for at danne Aβ-fragmenter med forskellige længder. Det er kendt, at den mest rigelige art af Aβ er Aβ40-fragmentet. Et andet kendt fragment dannet ud fra proteolytisk snit, mindre rigeligt end Ap40, er A42, mere tilbøjelige til at danne amyloidfibriller, som akkumuleres som en Ap-species i hjernen hos et individ med Alzheimers sygdom.
- En anden komponent til stede i Alzheimers sygdom er repræsenteret af neurofibrillære klynger, der består af bundter af filamenter, der er til stede i cytoplasmaet af neuroner. Neurofibrillære klynger er uopløselige og synes at være resistente overfor proteolyseprocesser in vivo og forbliver dermed til stede i vævssektioner, selv i lang tid efter neuronal død. Iagttagelse af strukturen består af de fibrillære klynger af dobbelthelixfilamenter og lineære filamenter med lignende sammensætning. Analyserer sammensætningen, er dobbelthjelmstrengene hovedsageligt lavet af hyperphosphoryleret tau-protein. Tau er et aksonalt protein associeret med mikrotubuli, hvilket letter dens samling.
Andre vigtige neuropatologiske ændringer, der forekommer i Alzheimers sygdom, omfatter mitokondriel dysfunktion, oxidativ neuronskader, synaptisk tab og axonal degeneration.
Neurokemiske aspekter
Som allerede forklaret, repræsenterer Aβ-peptid, der stammer fra den proteolytiske nedskæring af APP-forløberen, en neurotoksisk komponent af Alzheimers sygdom . Specifikt er det blevet hypotetiseret, at Aβ kan være vigtigt for normale hjernefunktioner, og hvis det overvinder visse koncentrationer, kan det blive neurotoksisk. Derudover kunne både aggregaterne og de forskellige isoformer af Aβ have en anden biologisk, fysiologisk eller patologisk rolle, der bestemmer og deltager i de efterfølgende stadier af sygdommen. Det er blevet observeret, at Aβ virker som en neuromodulator, der påvirker frigivelsen af nogle neurotransmittere i fravær af tydelige tegn på neurotoksicitet.
For eksempel kunne den neuromodulatoriske rolle Aβ i en fysiologisk kontekst have en vigtig betydning for den korrekte balance i neurotransmittersystemet. Det er velkendt, at dette system består af neurotransmittere, stoffer, som formidler information mellem cellerne, der udgør nervesystemet, neuronerne, gennem synaptisk transmission.
I patologiske tilstande kunne Aβ-medieret synaptisk transmission imidlertid være relateret til ændring af neurotransmission før neurodegenerative hændelser. Som et resultat af disse ændringer kan der opstå tidlige kognitive og ikke-kognitive lidelser baseret på de involverede neurotransmittersystemer og de forskellige hjerneområder involveret.
Ændringer af neurotransmittersystemerne og signaltransduktionsmekanismen i hjernen hos personer, der lider af Alzheimers sygdom er meget komplekse. Et af de systemer, der synes at være ændret, vedrører det kolinerge signalsystem, som involverer neurotransmitteren acetylcholin. Faktisk har det vist sig, at personer, der lider af Alzheimers sygdom, har reduceret cholinerge overførsel på niveau med cortex og hippocampus, vigtige hjerneområder dedikeret til fænomener som læring og hukommelse. Ud over dette neurotransmittersystem er ændringer i noradrenerge, serotonergiske såvel som glutamat- og GABA-systemer blevet observeret i Alzheimers sygdom.