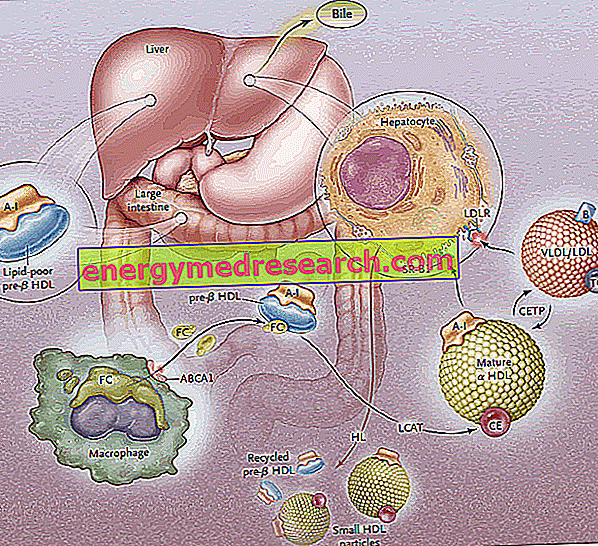
Omvendt kolesteroltransport (RCT) er den proces, hvormed cholesterol fjernes fra perifere væv gennem dets inkorporering i HDL lipoproteiner og efterfølgende transport til leveren til galde udskillelse.
Perifere celler, som alle ikke-tarm- eller leverceller, kan ikke nedbryde overskydende kolesterol; derfor er tilstedeværelsen af en mekanisme dedikeret til fjernelse af cholesterol fra cellerne væsentlig for vedligeholdelsen af cellulær homeostase. Denne mekanisme, der tager sigte på hepatisk genopretning af overskydende perifert kolesterol, kaldes "omvendt kolesteroltransport" (RCT: omvendt kolesteroltransport ).
Lad os undersøge processen i detaljer.
Biosyntesen af HDL lipoproteiner passerer gennem syntesen og den oprindelige sekretion af hovedproteinkomponenterne (apoproteiner) efterfulgt af ekstracellulær opkøb af lipider (phospholipider og cholesterol), hvilket fører til samling og dannelse af modne HDL-partikler.
Den første fase af omvendt kolesteroltransport består i tynd og leverproduktion af discoide precursorer af HDL, der på deres overflade udsætter apoproteiner (primært ApoA-I); Prækursormolekyler af HDL kaldet pre-B-HDL frigives således, hvilket indbefatter meget små mængder kolesterol og lipider, især phospholipider. Tilstedeværelsen af disse precursormolekyler ved det perifere niveau fremmer overførslen af overskydende frit kolesterol (FC) - undslippe fra perifere vævsceller - til apo AI gennem intervention af en membrantransportør kaldet ATP-bindende kassette A1 (ABCA1 ). Denne transportør er placeret på celleoverfladen og i Golgi-membranerne og kan transportere lipiderne fra Golgi-apparatet til cellemembranen, hvilket letter deres udstrømning. På dette tidspunkt, så snart det frie kolesterol går ind i de native HDL'er, intervenerer et plasmatisk enzym af hepatisk oprindelse, kaldet plasma-lecithin-cholesterol acyltransferase eller mere blot LCAT; dette enzym konverterer det frie cholesterol inkorporeret i pre-B-HDL i cholesterolestere, der transformerer præ-B-HDL i deres modne a-HDL-form; i praksis omdanner den kontinuerlige ophobning af cholesterol i lipoproteinkernen discoid HDL til sfæriske og klumpede partikler, som yderligere kan erhverve apoproteiner fra lipoproteinpartiklerne rige på triglycerider og smelte sammen. I hele processen spiller apolipoprotein AI en nøglerolle, der stimulerer både aktiviteten af ABCA1-transportøren og LCAT's aktivitet. Da ApoAI er det mest repræsenterede apolipoprotein i HDL, er plasmakoncentrationen direkte relateret til HDL-kolesterolniveauer.
BEMÆRK: esterificeringsprocessen er grundlæggende for at forhindre omfordeling af kolesterol fra HDL til plasmamembranen; denne mekanisme udnytter fedtsyren i position to til stede i phosphatidylcholinmolekylerne.
Den LCAT-medierede forestringsproces transformerer derefter præ-B-HDL molekylerne i deres "modne" a-HDL sfæriske form. Disse lipoproteiner transporteres derefter til leveren, hvor de frigiver kolesterol ifølge to forskellige ruter.
I et første tilfælde giver HDL højt indhold af esterificeret cholesterol dette lipid til lipoproteiner, der er rige på triglycerider (lipoproteiner med meget lav densitet og lavdensitet), og derefter opfanges af leveren gennem specifikke receptorer (LDL-R) og fjernes fra cirkulationen. Målet er at overføre perifert kolesterol til leveren via LDL-receptorsystemet og derefter "aflade" HDL fra overskydende kolesterol til perifert niveau for at gøre dem tilgængelige igen for at modtage det fra vævene; Tømmer sig selv af kolesterol, HDL'er accepterer triglycerider i bytte, og dette sker takket være cholesterol ester transfer protein (CETP). Opgaven med dette protein er derfor at fremme omfordeling og ligevægt af cholesterolestere og triglycerider mellem HDL, LDL, IDL, VLDL, chylomicron og chylomicron lipoproteiner, hvilket som et nettoresultat fører til en berigelse i HDL-triglycerider, til skade for cholesterolestere og en reduktion i HDL-størrelse.
Den anden vej involverer hepatiske SR-B1-receptorer til HDL, der er rig på esterificeret cholesterol, i fravær af samtidig nedbrydning af proteindelen af HDL, som derefter recirkuleres. I praksis giver dette enzym dig mulighed for at tømme HDL'erne fra deres indhold og regenerere nye pre-B-HDL'er. En del af HDL og ApoA-I er imidlertid internaliseret og nedbrydes på lysosomalt niveau, både i lever- og nyreceller. Optagelsen medieret af SR-B1 gøres mere effektiv ved aktiviteten af den hepatiske lipase, der er i stand til at remodelere HDL ved hydrolysering af overfladefosfolipiderne og tillade strømmen af esterificeret cholesterol fra lipoproteinkernen mod plasmamembranen (det er hypotetiseret mellem for det andet, at ApoE også er involveret i selektiv optagelse, da mus, der mangler for ApoE-genet, viser en reduktion af effekten af denne vej). SR-BI udtrykkes hovedsageligt i leveren, binyrerne og ovarie.